Отчего мы стареем: главный дирижер эндокринного оркестра
Всю историю идей и концепций в геронтологии можно вкратце охарактеризовать как историю поисков «часов» старения. В разное время в качестве таких «часов» побывали все эндокринные железы — гонады, надпочечники, щитовидная железа, гипофиз.
С утра до ночи — целый день
Часы считает палки тень.
Но если ночью Солнце спит,
То время, может быть, стоит?
А известный отечественный геронтолог В.М. Дильман полагал, что время жизни отсчитывает главный «дирижер» эндокринного оркестра, расположенный в основании головного мозга, — гипоталамус.
Вместе с тем в природе существует естественный механизм, определяющий все ритмы живых организмов, — это смена дня и ночи, света и темноты. Вращение нашей планеты вокруг своей оси и одновременно вокруг Солнца отмеряет календарные сутки, сезоны и годы, с которыми сверяют продолжительность жизни ее обитатели.
Природа снабдила живые организмы устройством, способным воспринимать световую информацию и преобразовывать ее в сигналы, управляющие ритмами организма. Центральная часть этого устройства — верхний придаток головного мозга, эпифиз.
Древние анатомы назвали его шишковидной (пинеальной) железой за сходство с сосновой шишкой. Основная функция эпифиза — передача информации о световом режиме окружающей среды во внутреннюю среду организма.
Так в организме поддерживаются физиологические ритмы, обеспечивающие адаптацию к условиям внешней среды. У рыб, земноводных, рептилий и птиц свет проходит через тонкий череп, а эпифиз обладает способностью непосредственного восприятия световых сигналов (возможно, поэтому его и называют «третьим глазом»).
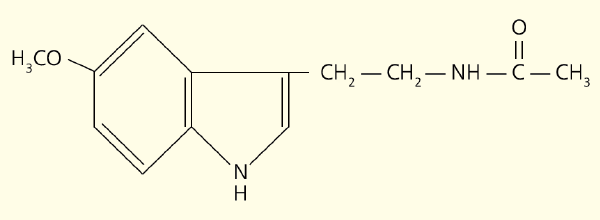
Рис. 1. Структурная формула мелатонина
У млекопитающих световая информация, воспринимаемая особыми клетками сетчатки глаз, передается в эпифиз по нейронам супрахиазматического ядра (СХЯ) гипоталамуса через ствол верхней грудной части спинного мозга и симпатические нейроны верхнего шейного ганглия. В темноте сигналы от СХЯ усиливают синтез и высвобождение норадреналина из симпатических окончаний.
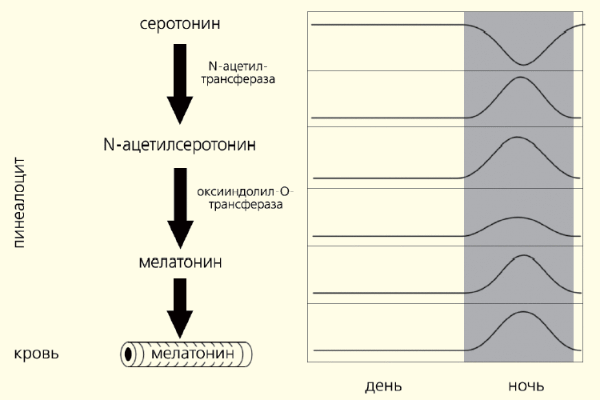
В свою очередь этот нейромедиатор возбуждает рецепторы, расположенные на мембране клеток эпифиза (пинеалоцитов), стимулируя синтез мелатонина (рис. 1). Этот основной гормон эпифиза — производное биогенного амина, серотонина, образующегося из поступающей с пищей аминокислоты триптофана. Активность ферментов, участвующих в превращении серотонина в мелатонин, подавляется освещением. Вот почему этот гормон синтезируется в темное время суток, когда его уровень в крови максимален, а в утренние и дневные часы — минимален (рис. 2).
Рис. 2. Биосинтез и суточный ритм мелатонина
В организме присутствует и экстрапинеальный (образующийся вне эпифиза) мелатонин. Это открытие принадлежит российским исследователям Н.Т. Райхлину и И.М. Кветному: в 1974 г. они обнаружили, что в клетках червеобразного отростка кишечника синтезируется мелатонин. Затем выяснилось, что этот гормон образуется и в других отделах желудочно-кишечного тракта, во многих других органах — печени, почках, надпочечниках, желчном пузыре, яичниках, эндометрии, плаценте, тимусе, а также в лейкоцитах, тромбоцитах и в эндотелии.
Биологическое действие экстрапинеального мелатонина реализуется непосредственно там, где он образуется. Синтез гормонов негормональными клетками подтверждает гипотезу эволюционной древности гормонов, которые, видимо, появились еще до обособления эндокринных желез. Вопрос о том, является ли этот путь синтеза гормона фотонезависимым, до сих пор окончательно не решен.
Световой режим, мелатонин и регуляция суточных биоритмов
Если эпифиз уподобить биологическим часам организма, то мелатонин можно сравнить с маятником, снижение амплитуды колебаний которого приводит к остановке этих часов. Пожалуй, точнее уподобить эпифиз солнечным часам, в которых мелатонин играет роль тени от гномона — стержня, отбрасывающего тень от солнца. Днем солнце высоко и тень коротка (уровень мелатонина минимален), в середине ночи — пик синтеза мелатонина эпифизом и секреции его в кровь. Важно, что мелатонин имеет околосуточный (циркадианный) ритм, т. е. единицей его измерения служит суточное вращение Земли вокруг своей оси.
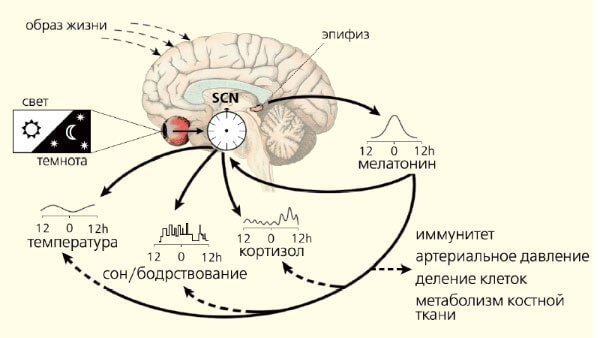
Все биологические ритмы строго подчиняются основному водителю, расположенному в супрахиазматических ядрах гипоталамуса. Их молекулярный механизм образуют «часовые» гены (Per1, Per2, Per3, Cry-1, Cry-2, Clock, Bmal1/Mop3, Tim и др.). Показано, что свет напрямую влияет на работу тех из них, что обеспечивают циркадианный ритм. Эти гены регулируют активность генов ключевого клеточного цикла деления и генов апоптоза. Гормоном-посредником, доносящим руководящие сигналы до органов и тканей, собственно, и служит мелатонин.
Характер ответа регулируется не только его уровнем в крови, но и продолжительностью ночной секреции. Кроме этого, мелатонин обеспечивает адаптацию эндогенных биоритмов к постоянно меняющимся условиям среды (рис. 3). Регулирующая роль этого гормона универсальна для всех живых организмов, о чем свидетельствует его присутствие и четкая ритмичность синтеза у всех животных, начиная с одноклеточных.
Рис. 3. Синхронизация биоритмов
Благодаря своим амфифильным свойствам (растворяется в воде и в жирах) мелатонин преодолевает все тканевые барьеры, свободно проходит через клеточные мембраны. Минуя систему рецепторов и сигнальных молекул, взаимодействуя с ядерными и мембранными рецепторами, он влияет на внутриклеточные процессы. Рецепторы к мелатонину обнаружены в различных ядрах гипоталамуса, сетчатке глаза и других тканях нейрогенной и иной природы.
У здоровых детей концентрация мелатонина в крови постепенно нарастает вплоть до года и сохраняется на достаточно высоком уровне до пубертатного периода. У ребят младшего возраста ночью количество мелатонина выше, чем днем, примерно в 40 раз. У маленьких детей этот гормон выполняет две функции: продлевает сон и подавляет секрецию половых гормонов. В период полового созревания количество циркулирующего в крови гормона снижается, причем наиболее отчетливо именно в период наступления половой зрелости. Разница между его ночной и дневной концентрацией сокращается до 10 раз. Отмечено, что у детей с замедленным половым созреванием уровень мелатонина более высокий. Если содержание гормона продолжает оставаться высоким (в пять и более раз выше возрастной нормы), половое созревание затягивается надолго.
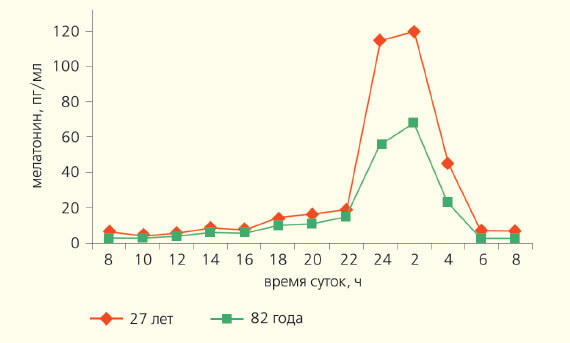
Вероятно, благодаря мелатонину взрослые люди видят эротические сны. Не без его участия сон переходит в «быструю стадию» (парадоксальный сон) и в памяти оживают яркие эмоциональные переживания, в том числе и связанные с сексом. У людей в возрасте 60–74 года большинство физиологических показателей претерпевают положительный фазовый сдвиг циркадианого ритма примерно на 1,5–2 ч вперед. У лиц старше 75 лет нередко возникает десинхронизация секреции многих гормонов, температуры тела, сна и некоторых ритмов поведения, что может быть связано с эпифизом, функция которого при старении угнетается (рис. 4).
Рис. 4. Суточный ритм концентрации мелатонина (пг/мл) в крови мужчин разного возраста. По оси ординат — мелатонин, пг/мл; по оси абсцисс — время суток, ч.
Если эпифиз — солнечные часы организма, то любые изменения длительности светового дня должны сказываться на его функциях и, в конечном счете, на скорости старения. В ряде работ показано, что нарушение фотопериодичности может существенно сокращать продолжительность жизни.
Американские исследователи М. Хард и М. Ральф обнаружили, что золотистые хомячки с особой мутацией в гене tau, отвечающем за генерацию ритмических сигналов в супрахиазматическом ядре гипоталамуса, жили на 20% меньше, чем контрольные.
Когда же в головной мозг мутантных хомячков имплантировали клетки гипоталамуса от здоровых зверьков, нормальная продолжительность жизни восстанавливалась. Разрушение супрахиазматических ядер приводит к сокращению продолжительности жизни животных.
Нарушение функции некоторых циркадианных генов вызывает преждевременное старение и развитие различных патологических состояний, включая увеличение чувствительности мышей к развитию опухолей (табл. 1).
Репродуктивная функция
После изобретения электрического освещения свет в ночное время (его часто называют световым загрязнением) стал существенной частью современного образа жизни (рис. 5), приводя к серьезным расстройствам поведения и состояния здоровья, включая сердечно-сосудистые заболевания и рак. Согласно гипотезе «циркадианной деструкции», такое изменение светового режима нарушает эндогенный суточный ритм, подавляет ночную секрецию мелатонина и снижает его концентрации в крови. Тщательно проведенные исследования показали, что освещенность в 1,3–4,0 лк монохромного синего света или в 100 лк белого света подавляет продукцию мелатонина эпифизом (рис. 6).
Рис. 5. Вид Земли из космоса ночью
У лабораторных грызунов искусственное увеличение длительности светового периода на 2–4 ч продлевает продолжительность эстрального (овуляторного) цикла и в некоторых случаях нарушает его.
При постоянном (24 ч/сут) воздействии света у большинства мышей и крыс очень быстро наступает состояние, эквивалентное климаксу у женщин. В яичниках таких животных обнаруживают кисты и гиперплазию клеток, продуцирующих половые гормоны. Вместо циклической секреции гонадотропинов, пролактина, эстрогенов и прогестерона, характерной для нормального репродуктивного периода, эти гормоны образуются ациклически, вызывая гиперпластические процессы в молочных железах и матке.
Имеются данные, что воздействие света ночью сокращает длительность менструального цикла у женщин с длинным (более 33 дней) циклом: так, среди обследованных медицинских сестер, часто работающих в ночную смену, у 60% он стал короче (25 дней), а около 70% жаловались на его сбои.
У крыс с нарушением овуляции снижается толерантность к глюкозе и чувствительность к инсулину. Установлено, что постоянное освещение увеличивает у них порог чувствительности гипоталамуса к угнетающему действию эстрогенов.
Этот механизм — ключевой в старении репродуктивной системы, и у самок крыс, и у женщин. Итак, влияние света ночью приводит к ановуляции и ускоренному выключению репродуктивной функции у грызунов и к дисменорее у женщин.
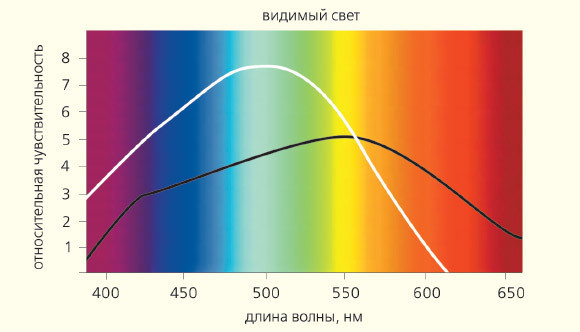
Рис. 6. Солнечный спектр и чувствительность клеток сетчатки — колбочек (цветная кривая) и палочек — к свету разной длины волны
Воздействие постоянного света усиливает перекисное окисление липидов в тканях животных и уменьшает общую антиокислительную и супероксиддисмутазную активности, тогда как применение мелатонина угнетает перекисное окисление липидов, особенно в головном мозге.
Антиоксидантный эффект мелатонина, открытый Р. Рейтером в 1993 г., подтвержден в многочисленных исследованиях. Основная направленность такого действия гормона — защита ядерной ДНК, протеинов и липидов, которая проявляется в любой клетке живого организма и в отношении всех клеточных структур.
Антиоксидантная активность мелатонина связана с его способностью нейтрализовать свободные радикалы, в том числе образующиеся при перекисном окислении липидов, а также с активизацией глутатионпероксидазы — мощного эндогенного фактора ферментативной защиты от радикального окисления.
В ряде экспериментов доказано, что мелатонин нейтрализует гидроксильные радикалы активнее, чем такие антиоксиданты, как глутатион и маннитол, а в отношении пероксильных радикалов он в два раза сильнее, чем витамин Е.
Сменная работа и здоровье
В настоящее время в некоторых отраслях промышленности число людей, работающих посменно, довольно значительно: так, в США их 20%, а в большинстве стран Европейского Экономического Сообщества — 15–20% от общего количества. Очевидные проблемы со здоровьем среди сменных рабочих включают нарушения сна, метаболизма и толерантности к липидам, желудочно-кишечные заболевания, увеличение случаев сердечно-сосудистых заболеваний, возможно и развитие диабета.
В этой группе чаще, чем у рабочих дневных смен, наблюдается ожирение, высокий уровень триглицеридов и холестерина, низкая концентрация липопротеинов высокой плотности.
С другой стороны, имеются доказательства, что такой метаболический синдром служит фактором риска не только сердечно-сосудистых заболеваний, но и злокачественных опухолей.
Имеются сведения о гораздо большем количестве смертей от злокачественных новообразований у сменных рабочих со стажем не менее 10 лет по сравнению с рабочими дневных смен. В Дании в большом исследовании (около 7 000 обследуемых в каждой группе) показано, что вечерняя работа достоверно увеличивает риск развития рака молочной железы у женщин в возрасте от 30 до 54 лет.
Аналогичные наблюдения отмечены в Финляндии и США при обследовании стюардесс на предмет рака молочной железы.
Установлено также, что риск рака возрастает с учащением ночной бессонницы, увеличением уровня ночного освещения и при работе в ночную смену. В последнем случае риск также возрастал с увеличением стажа работы (табл. 2).
В Норвегии при анализе данных о здоровье почти 45 тыс. медицинских сестер установлено, что показатель дополнительного риска рака молочной железы у работавших по ночам в течение 30 и более лет составил 2,21. Подобная картина в отношении рака толстой кишки обнаружена у длительно работавших по ночам жителей Сиэтла. Получены данные об увеличенном риске рака толстой кишки и рака прямой кишки у женщин, работающих на радио и телеграфе.
В 2003 г. Е. Шернхаммер и ее коллеги, проанализировав данные о состоянии здоровья 79 тыс. медсестер, обнаружили, что у работающих в ночные смены более высокий риск рака молочной железы. Рак толстой и прямой кишки встречаются чаще у рабочих, имеющих не менее трех ночных смен в месяц в течение 15 и более лет. Сообщают об увеличении риска рака простаты у скандинавских пилотов авиалиний в зависимости от количества продолжительных рейсов. Механизмы, лежащие в основе увеличенного риска рака среди ночных рабочих и летных экипажей, могут быть связаны с нарушением циркадианных ритмов и вынужденным воздействием света ночью, что и приводит к сокращению выработки мелатонина, известного биологического блокатора канцерогенеза.
Воздействие света и канцерогенез
Еще в 1964 г. немецкий исследователь В. Йохле отметил, что у мышей при круглосуточным освещении количество опухолей молочной железы и обусловленных ими смертей значительно больше, чем у животных, находящихся при обычном режиме.
Аналогичная закономерность прослеживалась и в отношении других опухолей. В 1966 г. сотрудник Московского онкологического научного центра И.О. Смирнова обнаружила гиперпластические процессы в молочной железе и мастопатии у 78–88% самок крыс через 7 мес. после начала воздействия постоянного освещения.
По данным И.А. Виноградовой, при содержании крыс при постоянном освещении до 18-месячного возраста доживает чуть больше половины самок, тогда как в комнате со стандартным режимом освещения к этому сроку были живы почти 90% животных. Спонтанные опухоли обнаружены у 30% крыс, содержавшихся при постоянном освещении, против 16% при стандартном режиме.
В опытах, проведенных в нашей лаборатории Д.А. Батуриным, у самок мышей, несущих ген рака молочной железы HER-2/neu, в результате постоянного освещения наблюдалось значительно больше аденокарцином молочной железы по сравнению с находящимися в стандартных условиях. Эффект был пропорционален интенсивности освещения. Воздействие постоянного освещения значительно ускоряло возрастные нарушения репродуктивной функции и существенно усиливало спонтанный канцерогенез у мышей линии СВА. Постоянное освещение, начатое в возрасте 30 дней, приводило к ускоренному развитию спонтанных аденокарцином эндометрия у крыс линии BDII/Han.
В 1965 г. И.К. Хаецкий из киевского Института проблем онкологии впервые сообщил о стимулирующем влиянии постоянного освещения на вызванный введением 7,12-диметилбензантрацена (ДМБА) канцерогенез молочных желез у крыс. При содержании животных с момента рождения при постоянном или стандартном освещениях количество аденокарцином молочных желез у крыс, получивших ДМБА в возрасте 55 дней, составило соответственно 95 и 60%. Применение мелатонина существенно задерживало развитие индуцированных опухолей в обеих группах.
В наших опытах введение крысам, содержащимся в обычных условиях, другого канцерогена, N-нитрозометилмочевины (НММ), привело к появлению у 55% животных аденокарцином молочных желез. При постоянном освещении количество этих новообразований значительно увеличивалось, а их латентный период уменьшался. У таких крыс ночью в сыворотке крови возрастала концентрация пролактина, а содержание мелатонина уменьшалось по сравнению с аналогичными показателями у крыс, находящихся в стандартных условиях.
В работе французских исследователей показано, что нарушение у крыс циркадианных ритмов, вызванное постоянным светом, стимулировало канцерогенез в печени, индуцируемый N-нитрозодиэтиламином. А.В. Панченко также отмечал, что при постоянном освещении у крыс увеличивалось количество аденокарцином в восходящем и нисходящем отделах толстой кишки при введении 1,2-диметилгидразина (ДМГ) по сравнению с крысами, содержащимися в стандартных условиях и также получившими инъекции этого канцерогена.
Мы совместно с Д.Ш. Бениашвили изучали влияние постоянного освещения на трансплацентарный канцерогенез, индуцируемый N-нитрозоэтилмочевиной. Крыс на протяжении всей беременности и вскармливания потомства содержали в комнате с круглосуточно включенным светом, после чего крысят переводили на обычный режим. Выяснилось, что даже кратковременное воздействие постоянного света стимулировало рост индуцируемых опухолей нервной системы и почек у потомства по сравнению с потомством крыс, находящихся в стандартных условиях. Таким образом, постоянное освещение активирует индуцированные химическими канцерогенами опухоли различных локализаций.
Недавно у больных раком молочной железы (в 95% случаев) обнаружены изменения в активности трех часовых генов (PER1, PER2, PER3). Это может привести к нарушению контроля над нормальным циркадианым ритмом и таким образом увеличить выживание раковых клеток и усилить неопластический процесс. В настоящее время пока неясно, уникален ли ген Per2 в качестве «супрессора опухоли» или имеются другие часовые гены с подобной противоопухолевой функцией. Механизм подавления роста опухоли также пока неясен, но имеется важное наблюдение — раковые ткани определенно связаны со специальными часовыми генами. В течение 2006 г. вышло еще шесть работ, свидетельствующих о нарушениях функций часовых генов у больных раком ряда других локализаций.
Данные, полученные на крысах и людях, показывают, что и в опухолях, и у самих особей значительно изменяются циркадианнные ритмы. Так, в наших экспериментах у крыс, имеющих рак толстой кишки, вызванный 1,2-диметилгидразином, нарушался циркадианный ритм мелатонина в сыворотке крови, в активности пинеалоцитов и содержании биогенных аминов в супрахиазматическом ядре гипоталамуса и преоптической области. Таким образом, экологические и генетические факторы, повреждающие системный и/или местный циркадианный ритм, могут ставить под угрозу временное регулирование деления клеток и таким образом усиливать рост опухоли.
Антистрессорные эффекты мелатонина
Эпифиз — важный элемент антистрессорной «обороны» организма, и мелатонину отводится в этом важная роль фактора неспецифической защиты. У высокоорганизованных животных и тем более человека пусковым моментом при развитии стресса служат негативные эмоции. Мелатонин способствует ослаблению эмоциональной реактивности. К отрицательным последствиям стресса можно отнести усиление свободно-радикального окисления, в том числе и перекисного окисления липидов, повреждающего клеточные мембраны. Стресс обязательно сопровождается обширными сдвигами в эндокринной сфере, которые в первую очередь затрагивают гипоталамо-гипофизарно-надпочечниковую систему. Участие мелатонина носит «поправочный» характер: гормон подключается к эндокринной регуляции только в случае резких отклонений в работе надпочечников.
Существует целая серия доказательств неблагоприятного влияния хронического стресса на иммунную систему. В частности, у лиц, длительное время переживающих психотравмирующую ситуацию, снижается уровень Т-лимфоцитов в крови. В этой ситуации мелатонин оказывает как прямое действие на иммунокомпетентные клетки, так и опосредованное, через гипоталамус и другие нейроэндокринные структуры.
Хронический стресс (например, связанный с болью или иммобилизацией) вызывает рассогласование суточных биоритмов, при этом возникают проблемы со сном, изменяется ЭЭГ, нарушается секреция ряда биологически активных соединений. И хотя основным «водителем ритма» в организме служит не эпифиз, а супрахиазматическое ядро гипоталамуса, оба этих образования взаимодействуют при посредничестве мелатонина (рецепторы к нему есть в клетках СХЯ), который способен ограничивать ход «спешащих часов» основного ритмоводителя.
Мелатонин, старение и развитие опухолей
Итак, в опытах на животных с индуцированным химическим канцерогенезом мелатонин тормозил рост опухолей различной локализации (молочной железы, шейки матки и влагалища, кожи, подкожной клетчатки, легких, эндометрия, печени, толстой кишки), что говорит о широком спектре его антиканцерогенного действия. Данные этих экспериментов на животных хорошо согласуются с результатами клинических наблюдений.
Так, канадские исследователи обобщили результаты 10 работ, в которых использовали мелатонин для лечения онкологических больных с солидными формами опухолей. У 643 пациентов, принимавших мелатонин, относительный риск смерти снизился до 0,66, причем серьезных побочных эффектов препарата в течение года не зарегистрировали.
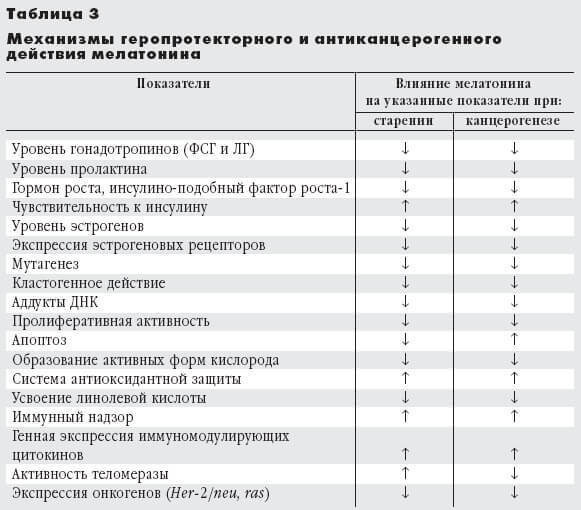
В последнее время активно обсуждаются возможные механизмы ингибирующего действия мелатонина на канцерогенез и старение. Установлено, что он эффективен на системном, тканевом, клеточном и субклеточном уровнях (табл. 3), препятствуя старению и раку. На системном уровне мелатонин снижает продукцию гормонов, способствующих этим процессам, стимулирует иммунный надзор, предупреждает развитие метаболического синдрома.
Одновременно подавляется продукция свободных радикалов кислорода и активируется антиоксидантная защита. Мелатонин тормозит пролиферативную активность клеток и повышает уровень апоптоза в опухолях, но уменьшает его в нервной системе, угнетает активность теломеразы. На генетическом уровне он подавляет действие мутагенов и кластогенов, а также экспрессию онкогенов (рис. 7).
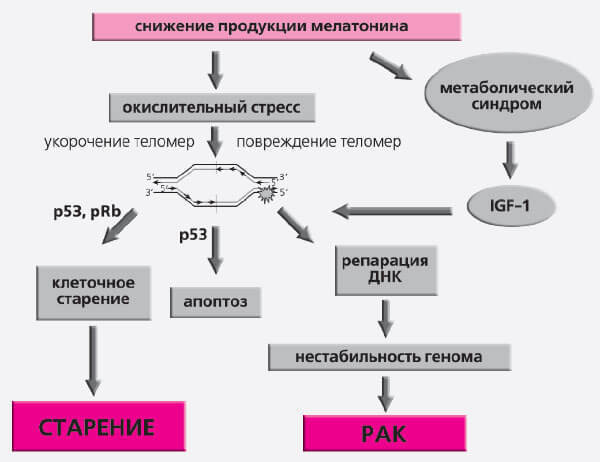
Рис. 7. Молекулярные механизмы влияния света и мелатонина на старение и рак
Все эти данные говорят о важной роли эпифиза в развитии рака. Угнетение его функции при постоянном освещении стимулирует канцерогенез. Эпидемиологические наблюдения относительно увеличения риска рака молочной железы и рака толстой кишки у рабочих ночных смен соответствуют результатам экспериментов на грызунах.
Применение эпифизарного гормона угнетает канцерогенез у животных и при обычном световом режиме, и при постоянном освещении. Значит, мелатонин может оказаться весьма эффективным для профилактики рака, особенно в северных регионах, где летом всегда светло («белые ночи»), а в течение долгой полярной ночи всюду горит электрический свет.
В отличие от многих гормонов, действие мелатонина на клеточные структуры зависит не только от его концентрации в крови и межклеточной среде, но и от исходного состояния клетки. Это позволяет считать мелатонин универсальным эндогенным адаптогеном, поддерживающим баланс организма на определенном уровне и способствующим адаптации к непрерывно меняющимся условиям окружающей среды и локальным воздействиям на организм.
В настоящее время во многих странах выпускаются препараты мелатонина, которые зарегистрированы в качестве лекарств или как биологически активные добавки. Сегодня уже накоплен некоторый опыт их применения при лечении различных заболеваний, прежде всего при нарушениях сна, язвенной болезни желудка и двенадцатиперстной кишки, гипертонической болезни.
В многочисленных исследованиях показано, что мелатонин замедляет процессы старения и увеличивает продолжительность жизни лабораторных животных — дрозофил, плоских червей, мышей, крыс.
Определенный оптимизм вызывают публикации о его способности повышать устойчивость к окислительному стрессу и ослаблять проявления некоторых ассоциированных с возрастом заболеваний людей, таких как макулодистрофия сетчатки, болезнь Паркинсона, болезнь Альцгеймера, гипертоническая болезнь, сахарный диабет. Всесторонние клинические испытания этого гормона существенно расширят его применение для лечения и профилактики возрастных заболеваний и, в конечном счете, преждевременного старения. опубликовано econet.ru
Автор: В. Н. Анисимов, доктор медицинских наук
P.S. И помните, всего лишь изменяя свое потребление - мы вместе изменяем мир! © econet
Источник: https://econet.ua/
Понравилась статья? Напишите свое мнение в комментариях.Подпишитесь на наш ФБ: , чтобы видеть ЛУЧШИЕ материалы у себя в ленте!





Добавить комментарий