Нобелевская премия по физиологии и медицине — 2021
В основе исследований, за которые была присуждена Нобелевская премия 2021 года, лег практически весь научный багаж генетики — клонирование, гибридизация ДНК, изучение структуры белков, эксперименты на клеточных культурах и на животных и т.д. В результате учеными был установлен механизм, обеспечивающий сенсорное восприятие разнообразных стимулов.
Нобелевская премия по физиологии и медицине в этом году была вручена Дэвиду Джулиусу (David Julius) и Ардему Патапутяну (Ardem Patapoutian) «за открытие рецепторов, обеспечивающих восприятие температурных и механических стимулов».
Кто получил Нобелевскую премию по физиологии и медицине в 2021 году
Рецепторы термочувствительности (сначала рецепторы горячего, а через некоторое время и рецепторы холодного) были открыты в 1997–2003 годах. Пальма первенства тут принадлежит Джулиусу, открывшему три таких рецептора. Еще несколько рецепторов этих типов открыл чуть позднее Патапутян. Пара наших важнейших механорецепторов была открыта группой Патапутяна в работах 2010–2017 годов. В основу исследований, за которые была присуждена премия, лег чуть ли не весь арсенал современной генетики — клонирование, гибридизация ДНК, секвенирование, сравнительный анализ последовательностей, изучение структуры белков, — и, конечно же, эксперименты непосредственно на клеточных культурах и на животных, которые позволили во всей полноте установить механизм, обеспечивающий сенсорное восприятие разнообразных стимулов.
Подписывайтесь на наш youtube канал!
Дэвид Джулиус (David Julius) родился в Нью-Йорке в 1955 году, степень бакалавра получил в Массачусетском технологическом институте, а степень доктора философии (Ph. D.) — в Калифорнийском университете в Беркли. С 1990 года работает в Калифорнийском университете в Сан-Франциско. Ардем Патапутян (Ardem Patapoutian), рожденный в Ливане в 1967 году, переехал в США в 1986 году. Он окончил Калифорнийский университет в Лос-Анджелесе, а докторскую степень получил в Калтехе в 1996 году. С 2000 года работает в Научно-исследовательском институте Скриппса (Scripps Research). Таким образом, все отмеченные премией работы обоих лауреатов проводились на территории США.
Рис. 2. Коллеги по Калифорнийскому университету в Сан-Франциско (University of California San Francisco, UCSF) поздравляют Дэвида Джулиуса с присуждением Нобелевской премии. Фото с сайта ucsf.edu
Работа Джулиуса уже была отмечена несколькими престижными наградами, в частности, он получил Премию за прорыв в области медицины за 2020 год («за прояснение механизмов болевой чувствительности»).
Чем же примечательны исследования лауреатов? Все начиналось с довольно незамысловатых — даже «детских» — вопросов. Каким образом компоненты перца и мяты вызывают ощущения горячего и холодного? Каким образом мы ощущаем прикосновения и работу собственных мышц и внутренних органов? Как мы слышим? Как горячее, холодное, или механическое воздействие на тело заставляют чувствовать боль? Удивительно, но к концу XX века детальных ответов на эти вопросы у физиологов толком не было.
Подписывайтесь на Эконет в Pinterest!
Собственно, нервные пути, по которым распространяются те или иные ощущения, проделывая путь от кожи или иных участков тела, где находятся чувствительные нервные окончания, к спинному мозгу (и далее в головной мозг — где формируются уже осознанные ощущения), были в основном более или менее известны физиологам уже в 1980-х. И уже тогда было хорошо известно, что возбуждение начинается с изменения электрического потенциала на цитоплазматической мембране чувствительных нейронов, а значит, с открывания каких-то ионных каналов, встроенных в мембраны этих клеток. Так что целью Джулиуса и Патапутяна было выяснить, какие именно белки обеспечивают определенные формы чувствительности, какими свойствами они обладают, какими генами обеспечивается их синтез и насколько широки их функции в организме.
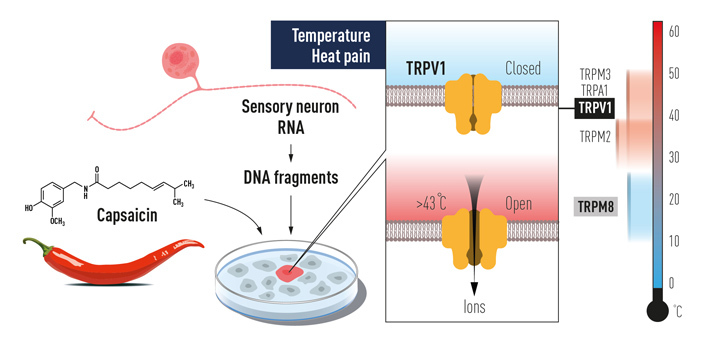
Первой на эту тема стала опубликованная в 1997 году статья от команды Дэвида Джулиуса, где сообщалось об открытии рецептора, чувствительного к капсаицину (алкалоиду, ответственному за остроту перца), и, вместе с тем, к умеренно высоким температурам — от 43°C (M. J. Caterina et al., 1997. The capsaicin receptor: a heat-activated ion channel in the pain pathway). Собственно, о том, что это должен быть один и тот же рецептор, было известно заранее, а использовать химический индуктор для экспериментов технически проще — меньше риска получения побочных эффектов из-за повреждения клеток и т. п. Схема работы (ее проводили на клетках мышей) показана на рис. 3. Искомый белок сначала обозначили VR1 (от vanilloid receptor — ванилоидный рецептор), но затем сравнительный анализ показал, что по своей структуре он сходен с белком TRP (transient receptor potential), ранее обнаруженным в зрительных сенсорах у дрозофил. Это и стало причиной того, что впоследствии название было изменено на TRPV1 (transient receptor potential cation channel subfamily V member 1). Любопытно, что гомолог белка VR1 птиц не реагирует на капсаицин, поэтому птицы спокойно едят перец и распространяют его семена, а вот млекопитающих острота отпугивает (этот факт тоже был установлен в группе Джулиуса, S. Jordt, D. Julius, 2002. Molecular basis for species-specific sensitivity to «hot» chili peppers).
Рис. 3. Схема исследования, послужившего начальным шагом в изучении терморецепторных белков. Справа показана температурная шкала с диапазонами для активации разных термочувствительных рецепторных каналов семейства TRP, которые были обнаружены в 1997–2003 годах. Выделение РНК из нервных клеток, реагирующих на капсаицин, с последующим получением ДНК-копий, их клонированием и испытанием в клеточных или бесклеточных системах, в итоге позволило идентифицировать белки, которые интересовали исследователей.
Этот белок, как и все прочие члены семейства TRP (в сумме их у млекопитающих обнаружилось аж 28), формирует ионный канал, который в открытом состоянии пропускает разнообразные моновалентные и дивалентные неорганические катионы (в первую очередь это Na+ и Ca2+), а также способен пропускать и органические катионы, в том числе довольно крупные. Ионный канал формируется четырьмя молекулами белка. Каждая отдельная белковая молекула имеет шесть гидрофобных участков, которые пронизывают мембрану, заякоривая в ней белок. Концы белковых молекул выходят на противоположные стороны от мембраны, формируя внеклеточный и внутриклеточный домены. Через них рецептор может взаимодействовать с другими молекулами экзогенного или эндогенного происхождения, которые могут влиять на работу канала.
TRPV1, будучи терморецептором, изменяет свою конформацию при воздействии повышенной температуры таким образом, что канал переходит в открытое состояние. Аналогичные изменения в конформации белка возникают и при взаимодействии с капсаицином красного перца, некоторыми пептидами (токсинами паука), а также с продуктами гидролиза мембранных фосфолипидов ферментом фосфолипазой — фосфоинозитидами. Открытие канала приводит к деполяризации мембраны нервного окончания и возникновению потенциала действия, направляемого далее в ЦНС. Возникающие при этом ощущения — это то самое чувство ожога, то есть боли, которая заставляет нас отдергивать руку от горячего, и заливать холодной водой пожар во рту после обеда в индийском ресторане.
Этот же рецептор оказался причастен и к возникновению боли в месте воспаления. Оказалось, что порог активирующей его температуры снижается на фоне повышения кислотности среды. При pH 6,4 канал открывается уже при 37°C, то есть при обычной температуре тела, а если pH опускается до 5,9 — то и при 32°C. Кислая среда создается в области воспаления за счет работы лейкоцитов. Но тут же можно вспомнить и жгучую боль от укуса муравья (ведь его «оружие» — муравьиная кислота). Надо отметить, что Джулиус с коллегами продолжает активные исследования рецептора TRPV1: буквально месяц назад в журнале Cell вышла статья, посвященная изменениям его структуры при разных условиях (K. Zhang et al., 2021. Structural snapshots of TRPV1 reveal mechanism of polymodal functionality; к ней прилагается видео, показывающее модель открывания рецептора TRPV1 при связывании с пептидным токсином паука DkTx)
Через два года после пионерской работы Джулиуса. вышла публикация о еще одном похожем рецепторе. Его сначала назвали VRL-1, теперь же он обозначается TRPV2. Его активация требует более высоких температур (от 52°C), и он не реагирует ни на капсаицин, ни на кислотность среды. Сходство по аминокислотной последовательности для двух мышиных белков — 49%. Оба белка имеют ортологи и у человека.
Подписывайтесь на наш аккаунт в INSTAGRAM!
Следующим на очереди стал рецептор холода. Сложно сказать, насколько это удивительно или закономерно, но один и тот же рецептор был описан в двух статьях, вышедших практически одновременно в начале 2002 года в двух престижнейших журналах: статья Дэвида Джулиуса — в журнале Nature (D. D. McKemy et al., 2002. Identification of a cold receptor reveals a general role for TRP channels in thermosensation), а статья Ардема Патапутяна — в журнале Cell (A. M. Peier et al., 2002. A TRP channel that senses cold stimuli and menthol). Новооткрытый белок Джулиус назвал CMR1, а Патапутян TRPM8 — это название и было оставлено в итоге, поскольку снова это был белок из семейства TRP. Поиски рецептора опять велись при помощи вещества-агониста. Только на этот раз эту роль выполнял ментол — вещество из мяты перечной. Да-да, этот холодок от мятной жвачки вовсе неспроста — ментол действительно активирует те же самые нервные окончания, которые сообщают мозгу о прикосновении к чему-то прохладному, — причем, через взаимодействие с теми же самыми рецепторными каналами.
В течение следующего года в лаборатории Патапутяна были открыты еще два терморецептора из семейства TRP. Один из них, TRPA1, реагирует на очень низкие температуры — такие, при взаимодействии с которыми может даже ощущаться боль. Кроме того, позднее было установлено, что канал из этого белка может активироваться при взаимодействии с широким спектром летучих веществ и ядов, вызывая раздражение в слизистых оболочках (кашель, слезоточивость) и чувство боли и зуда (например, при укусах некоторых насекомых, скорпионов и т. д.). С мутациями этого белка связаны некоторые синдромы хронической боли и гиперчувствительности.
Интересно, что среди нервных волокон, несущих рецепторы холода, примерно у половины одновременно присутствуют и рецепторы горячего. Как эти волокна дифференцируют разные стимулы и доносят правильную информацию в мозг — пока не совсем понятно.
Еще один рецептор, TRPM3 — реагирует на мягкое тепло. Этот рецептор обнаруживается на мембранах кератиноцитов кожи, а не нейронов, где обычно находятся все выше упомянутые рецепторы. Предполагается, что работа этого рецептора может быть существенна в отношении скорости появления возрастных изменений кожи.
Если вас беспокоит зубная боль, то ее виновника опознали совсем недавно (L. Bernal et al., 2021. Odontoblast TRPC5 channels signal cold pain in teeth). Им оказался рецепторный белок TRPC5, экспрессирующийся в одонтобластах — особых клетках, которые размещаются в пульпе зуба. Из-за этого белка мы испытываем это ужасное ощущение, когда, откусив мороженого, вместо ожидаемого удовольствия, вдруг чувствуешь, как от холода начинают неприятно болеть все зубы одновременно.
Интересно, что рецептор TRPV2 был обнаружен также в клетках внутренних органов, не являющихся нейронами (например, на фибробластах — клетках соединительной ткани). В этих клетках он регулирует транспорт кальция внутрь в ответ на сигналы, не связанные с повышенной температурой (M. Kanzaki et al. 1999. Translocation of a calcium-permeable cation channel induced by insulin-like growth factor-I). В частности, было установлено, что этот канал регулируется связыванием с инсулиноподобным фактором роста — важнейшим белком, поддерживающим деление клеток у животных.
Практические аспекты описываемых работ лежат в области медицинской проблематики, связанной с поиском причин патологических болей и разработкой средств для их оптимального лечения. Вот лишь один пример. Как было сказано выше, рецепторные ионные каналы TRPV1 и TRPV2 способны пропускать органические катионы. Это их свойство стало предпосылкой для разработки нового подхода к проведению анестезии. Всем знакомый лидокаин, будучи неполярным органическим соединением, может проникать через липидную клеточную мембрану посредством диффузии. В нейронах он связывает изнутри и блокирует работу каналов натрия, чем и обусловлен его анестезирующий эффект. Проникновение лидокаина в клетки неизбирательно — воздействие оказывается на все типы нейронов. В области инъекции теряется не только всякая чувствительность, но и возможность управлять мышцами. В эксперименте ученые проводили инъекцию в заднюю конечность смеси из катионных производных лидокаина и капсаицина (он был нужен для стимуляции открытия канала TRPV1). В итоге порог болевой чувствительности был заметно повышен, но при этом крысы в полной мере сохранили способность двигать ногами и воспринимать неболевые стимулы в области инъекции.
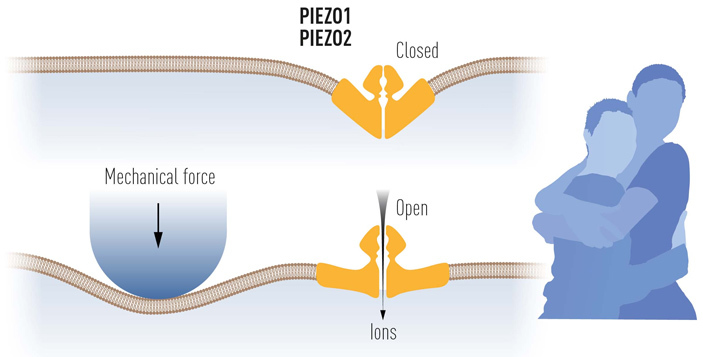
Еще один важный класс рецепторов, который был открыт и изучен в работах лауреатов — это так называемые механорецепторы, реагирующие на давление или другие виды механического воздействия (как внешнего, так и внутреннего). По крайней мере для животных белки с функцией механорецепторов впервые были идентифицированы в 2010 году группой Патапутяна (B. Coste et al., 2010. Piezo1 and Piezo2 Are Essential Components of Distinct Mechanically Activated Cation Channels). У позвоночных их оказалось два: PIEZO1 и PIEZO2 (открытие было сделано на культуре мышиных нейробластов). У большинства видов, впрочем, обнаруживается только один этих гомологов. Гомологичный им белок был выявлен, между прочим, и у растений (в частности, на клетках корневого чехлика, см. S. A. R. Moustavi et al., 2021. PIEZO ion channel is required for root mechanotransduction in Arabidopsis thaliana), а также у одноклеточных эукариот. Вместе с тем белки PIEZO не имеют признаков гомологии с некоторыми другими белками-механорецепторами, выявленными намного раньше у бактерий и архей.
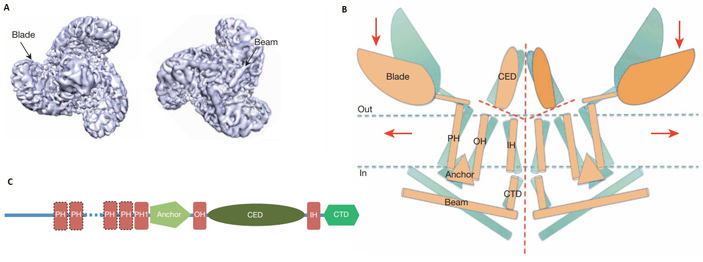
В 2012 году группой Патапутяна было подтверждено предположение, что белки PIEZO формируют пору (ионный канал) в мембранах клеток млекопитающих (B. Coste et al., 2012. Piezos are pore-forming subunits of mechanically activated channels). Оказалось, что каждая пора состоит из трех одинаковых молекул белка, но при этом сами белки не имеют жесткой предсказываемой структуры. Предполагается наличие 16–18 гидрофобных участков, пронизывающих мембрану.
Рис. 4. Модель структуры белка PIEZO1 построенная на основе данных, полученных при помощи криогенной электронной микроскопии. А — вид с наружной (слева) и с внутренней стороны мембраны на полный рецептор, образуемый тремя одинаковыми молекулами белка PIEZO1. В рецепторе можно выделить центральную область, в которой, собственно, и находится пора для тока ионов, и периферические лопасти (Blade). С внутренней стороны лопасти поддержаны структурами типа балок (Beam). В — схематическое изображение топологии рецептора в мембране при виде сбоку. На рисунке показаны две субъединицы порового комплекса. В каждой субъединице можно выделить несколько структурных участков-доменов: центральная часть рецептора образована из C-концевого внеклеточныго домена (CED), внутренней и внешней спиралей (IH, OH), C-концевого домена (CTD); периферическая часть рецептора включает якорный домен (Anchor) и периферические спирали (PH), формирующие боковые лопасти и балки. Показано, как рецептор меняет конфигурацию в процессе активации при деформации мембраны вследствие механического воздействия. Неактивному состоянию рецептора соответствует голубой цвет, активированному — оранжевый. С — линейная схема взаимного расположения указанных выше доменов в молекуле белка. Рисунок статьи J. Ge et al., 2015. Architecture of the mammalian mechanosensitive Piezo1 channel
И, наконец, только в 2016 году этой же научной группой было окончательно доказано, что стимулом для активации ионного канала, образованного белками PIEZO, является непосредственно деформация билипидного слоя мембраны, а не какие-то дополнительные молекулы-посредники (R. Syeda et al., 2016. Piezo1 channels are inherently mechanosensitive).
У млекопитающих сходство аминокислотных последовательностей паралогов PIEZO1 и PIEZO2 составляет 42%. Оба белка обнаруживаются в нервных окончаниях, подходящих к чувствительным структурам в коже и мышцах (клетки Меркеля, тельца Мейснера, нервно-мышечные веретена, сухожильный орган Гольджи). Именно работой этих ионных каналов обеспечивается восприятие тактильных ощущений в коже (S. S. Ranade et al., 2015. Piezo2 is the major transducer of mechanical forces for touch sensation in mice), а также проприоцепция — способность ощущать положение собственных частей тела относительно друг друга, чувствовать напряжение собственных мышц (S. Woo et al., 2015. Piezo2 is the principal mechanotransduction channel for proprioception).
Рис. 5. Схема работы механорецепторного канала, построенного из белков PIEZO, открытых Ардемом Патапутяном. Механическое давление вызывает изгибание клеточной мембраны, что, в свою очередь, меняет конформацию механорецептора и открывает пору для тока ионов. Благодаря этой молекулярной «механике» мы и можем ощущать радость объятий. Рисунок с сайта nobelprize.org
У людей особенно высокая концентрация механорецепторов обнаруживается в коже ладоней и пальцев. Скопления механорецепторов обнаруживаются в чувствительных участках кожи и у животных, которые в значительной мере полагаются на осязание при добывании пищи, — например, в отростках на носу у крота-звездоноса, на кончике клюва уток и в волосяных фолликулах у основания вибрисс кошек и мышей.
Некоторые нервные окончания могут содержать одновременно белки PIEZO и TRPV2 — такие нервные окончания несут в мозг болевые сигналы, связанные с некоторыми механическими воздействиями (например, укол иглой).
Нельзя не сказать и о том, что, начав с изучения механорецепторов в качестве «деталей» механизма сенсорного восприятия, ученые столкнулись с гораздо более широкой функциональной ролью этих белков. На этот факт указывает уже хотя бы то, что попытки получить мышей с нокаутом любого из двух белков PIEZO оказались совершенно бесполезными. Эмбрионы гибли на ранних сроках развития.
На сегодняшний день известно около 25 мутаций, затрагивающих эти белки, которые приводят к тяжелым порокам развития у людей. Белок PIEZO2 экспрессируется только в нейронах. Аномалии в этом белке приводят к нарушению развития опорно-двигательного аппарата — атрофии мышц, врожденному сколиозу и т. д. Белок PIEZO1 оказался достаточно широко экспрессируемым в разных типах клеток. Особенно высока его концентрация в легких, почках, мочевом пузыре, сердце и кровеносных сосудах. Все это полостные органы, функционирование которых подразумевает механические сжатия и растяжения. Недостаточность функционирования PIEZO1 в эмбриональном периоде приводит к невозможности нормального развития системы кровеносных сосудов. Но, в то же время, избыточность функции белков PIEZO бывает связана с гиперчувствительностью к боли и синдромами хронических болей, среди которых широко и печально известна мигрень (A. Della Pietra et al., 2020. The Emerging Role of Mechanosensitive Piezo Channels in Migraine Pain). Для любопытствующих можем порекомендовать обстоятельный обзор разнообразия функций механорецепторов PIEZO у млекопитающих (J. Wu et al., 2016. Touch, Tension, and Transduction — the Function and Regulation of Piezo Ion Channels).
Подписывайтесь на Эконет в Pinterest!
Также оказалось, что белок PIEZO1 в больших количествах присутствует на адипоцитах — основных клетках жировой ткани. Как выяснилось, этот рецептор составляет важное звено в контроле созревания адипоцитов и функционирования жировой ткани, в том числе при употреблении высококалорийной диеты (S. Wang et al., 2020. Adipocyte Piezo1 mediates obesogenic adipogenesis through the FGF1/FGFR1 signaling pathway in mice).
В настоящее время исследованиями различных аспектов работы температурных, болевых и механических рецепторов, открытых группами Джулиуса и Патапутяна, занимаются сотни лабораторий по всему миру. Изучение этих белков не только позволило разобраться в деталях генерирования тех или иных сенсорных ощущений у человека, но и привело к пониманию, что те же самые рецепторы вовлечены в обеспечение нормального развития и функционирования множества тканей и органов в нашем теле. Получаемые фундаментальные знания в конечном итоге помогают в поиске оптимальных стратегий решения медицинских задач. В особенности это касается аспектов патологической боли, в том числе хронической, которая серьезно снижает качество жизни многих людей.опубликовано econet.ru.
Автор Романовская Татьяна
Лучшие публикации в Telegram-канале Econet.ru. Подписывайтесь!
P.S. И помните, всего лишь изменяя свое сознание - мы вместе изменяем мир! © econet
Источник: https://econet.ua/
Понравилась статья? Напишите свое мнение в комментариях.Подпишитесь на наш ФБ: , чтобы видеть ЛУЧШИЕ материалы у себя в ленте!




Добавить комментарий